В 2022 г. всего одобрено 86 Протоколов (из них, более половины – 66% (57) - для взрослого населения, 34% (29) - для детского населения и в области акушерства и гинекологии) от 29 федеральных организаций-разработчиков для оказания медицинской помощи 13,6 тыс. пациентов.
С 2015 г. в разработке и реализации Протоколов участвует более 40 федеральных организаций, одобрено 677 Протоколов на оказание медицинской помощи в рамках клинической апробации. Последние годы количество утвержденных Протоколов колеблется в диапазоне от 70 до 80, преимущественно для взрослого населения.

ЛИДИРУЮЩИЕ РАЗРАБОТЧИКИ
В 2022 г. наибольшее количество одобренных Протоколов представлено ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
В TOP10 федеральных организаций-разработчиков также входят: ФГАУ «Национальный медицинский исследовательский центр нейрохирургии имени академика Н.Н. Бурденко» Минздрава России, ФГБОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России, ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии имени А.Н. Бакулева» Минздрава России, ФГБУ «Национальный медицинский исследовательский центр хирургии имени А.В. Вишневского» Минздрава России, ФГАУ «Лечебно-реабилитационный центр» Минздрава России, ФГБУ «Национальный медицинский исследовательский центр глазных болезней имени Гельмгольца» Минздрава России, ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Минздрава России, ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России.

ЛИДИРУЮЩИЕ ТЕХНОЛОГИИ
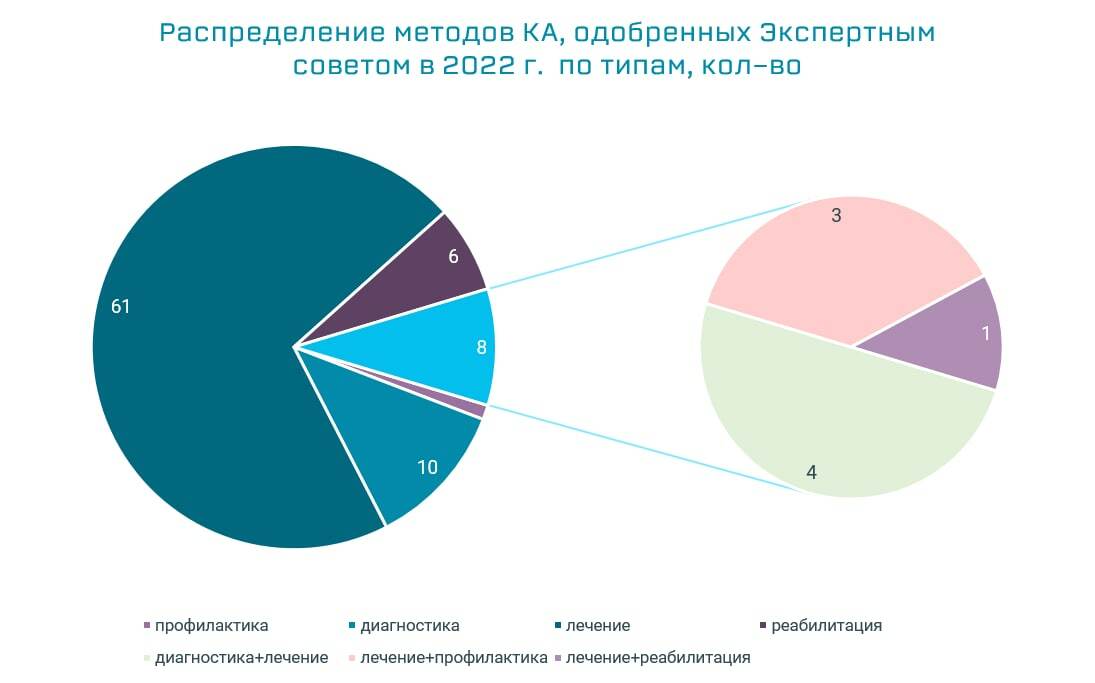
Как и в предыдущие периоды, большинство Протоколов направлено на оценку эффективности методов лечения. В 2022 г. их количество составило 61, 10 – направлены на оценку методов диагностики, 8 - комбинированных (смешанных) методов, 1 - профилактики.
ЛИДИРУЮЩИЕ ПРОФИЛИ МЕДИЦИНСКОЙ ПОМОЩИ
В 2022 г. наибольшее число одобренных Протоколов представлено по профилю «сердечно-сосудистая хирургия» (21), «онкология» (14), «акушерство и гинекология» (11), «медицинская реабилитация» (7), а также «нейрохирургия» (5). Это свидетельствует о положительной тенденции продвижения и внедрения в практическое здравоохранение инновационных медицинских технологий для лечения социально значимых заболеваний.

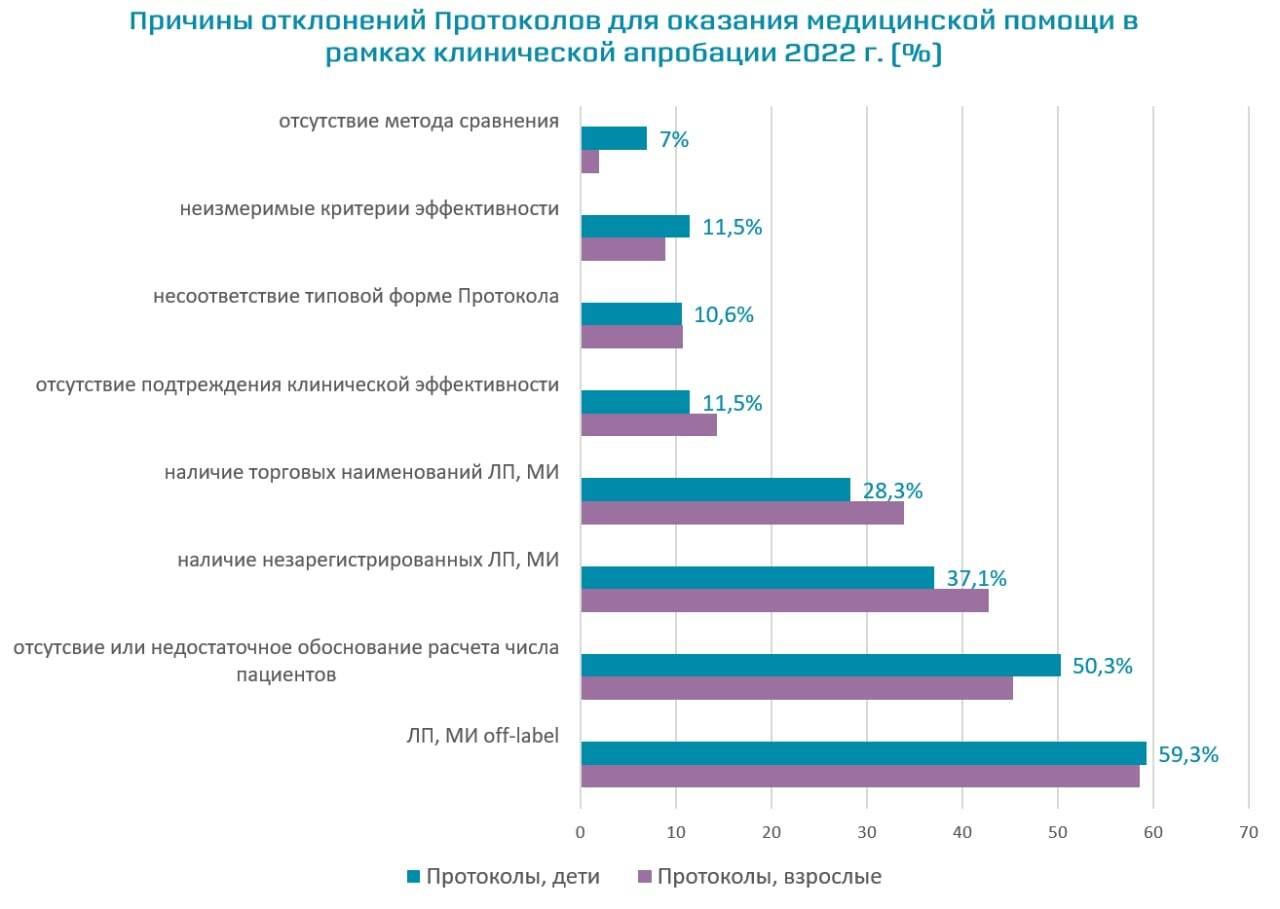
В 2022 г. одной из основных причин отклонений Протоколов Экспертным советом Минздрава России в связи с несоответствием требованиям законодательных и нормативных правовых документов, регламентирующих вопросы клинической апробации, стало включение лекарственных препаратов и/или медицинских изделий вне показаний к применений (off-label). Важно отметить, что с 1 сентября 2022 г. вступает в силу новый приказ Минздрава России (от 02.02.2022 №46н), регламентирующий вопросы клинической апробации, в рамках которого предусмотрена возможность применения в рамках клинической апробации лекарственных препаратов off-label, при наличии ссылок на клинические исследования эффективности и безопасности, либо ссылок в ведущих отечественных и (или) зарубежных рецензируемых научных журналах и изданиях.
Среди причин отклонений Протоколов также достаточно часто отмечалось отсутствие расчетов или недостаточное обоснование числа пациентов, наличие в Протоколе незарегистрированных на территории РФ лекарственных препаратов и/или медицинских изделий или их торговых наименований. При этом значительно сократилось количество Протоколов с отсутствием описания метода сравнения и финансового обоснования медицинской помощи пациенту в рамках клинической апробации, что представляло одну из основных причин отклонений в предыдущие периоды.